|
 |
|
| Wszystkie metale o ujemnych standardowych potencjałach elektrodowych, to jest znajdujące się w szeregu przed wodorem, wypierają wodór z rozcieńczonych kwasów, których aniony nie wykazują właściwości utleniających, a przy tym rozpuszczają się w nich. |
|
|
 |
HTML5 Canvas |
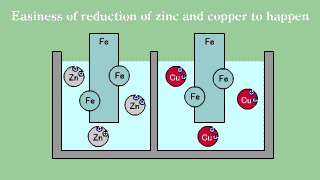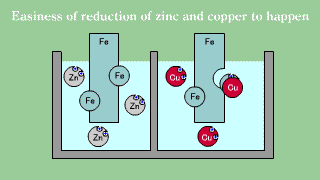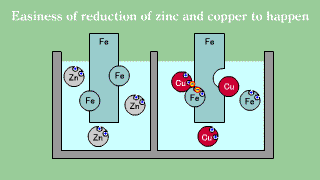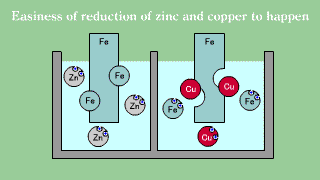
| Blaszka żelazna umieszczona w roztworze soli miedziowej powoduje odkładanie się warstwy metalicznej miedzi w miarę, jak żelazo przechodzi do roztworu. Blaszka żelazna umieszczona w roztworze soli cynkowej nie powoduje wydzielania się metalicznego cynku. |
|
|
 |
|
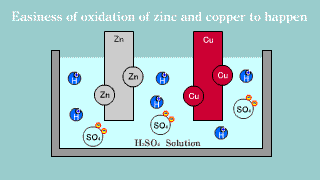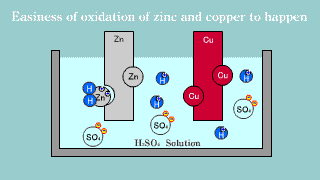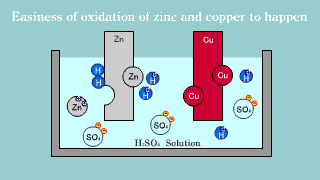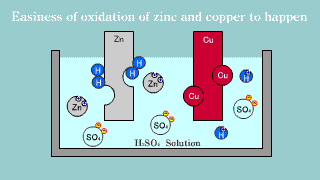
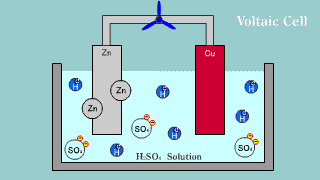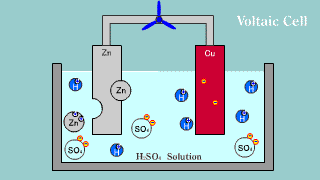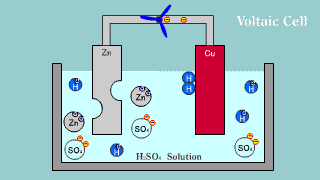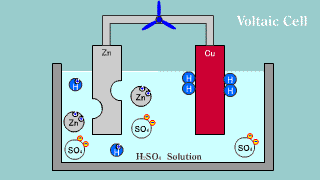
| Na elektrodzie cynkowej zachodzi utlenianie jej materiału do kationów Zn2+, które przechodzą do roztworu, gdzie przeciwjonami dla nich są aniony siarczanowe SO42-, pochodzące z dysocjacji kwasu siarkowego. Na elektrodzie miedzianej zachodzi reakcja redukcji jonów hydroniowych do gazowego wodoru. |
|
|
 |
|
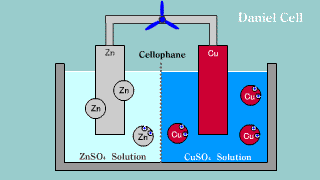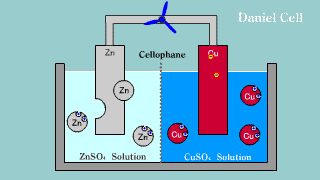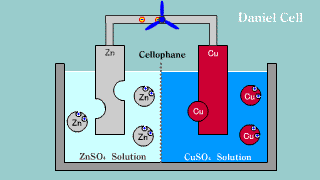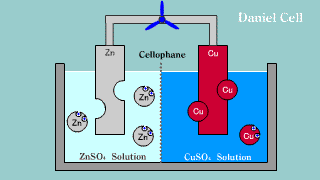
| W ogniwie tym na elektrodzie cynkowej (anoda) zachodzi reakcja utleniania cynku: Zn → Zn2++ 2e-. Na elektrodzie miedziowej (katoda) zachodzi proces redukcji: Cu2+ + 2e- → Cu. |
|
|
 |
|
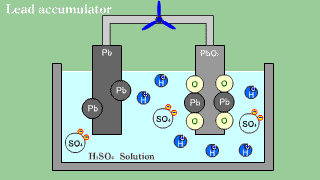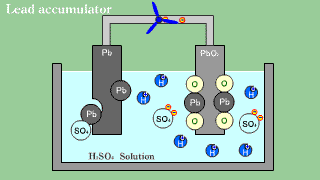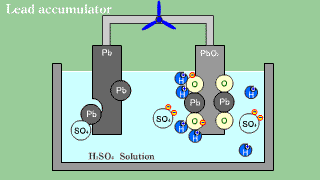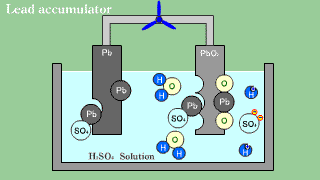
| Akumulator kwasowo-ołowiowy zawiera anodę ołowiową, katodę z tlenku ołowiu PbO2 oraz roztwór wodnego kwasu siarkowego, spełniającego funkcję elektrolitu. |
|
|
 |
|
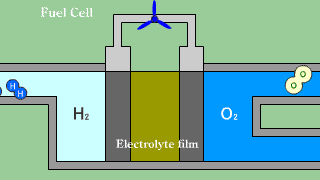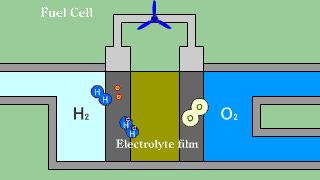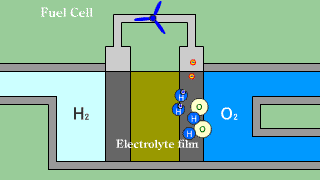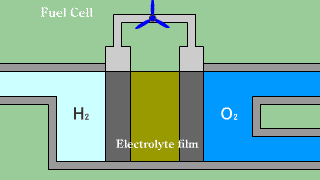
Ogniwa wodorowo-tlenowe z membraną do wymiany protonów. Gazowy wodór wprowadzany jest w obszar porowatej anody, gdzie w wyniku oddziaływania wodoru z materiałem katody zachodzi dysocjacja. Półprzepuszczalna membrana jest przewodnikiem tylko dla protonów. Elektrony muszą dotrzeć do katody poprzez obwód elektryczny, wytwarzając prąd pozwalający na zasilanie urządzeń. Na katodzie tlen reaguje z elektronami tworząc jony O2-. Jony wodorowe H+ są zobojętniane zjonizowanym tlenem. |
|
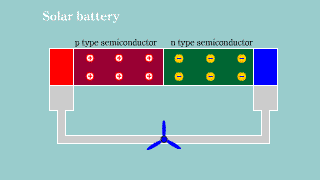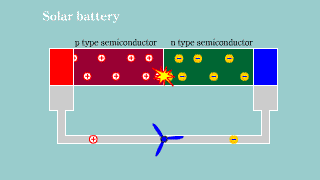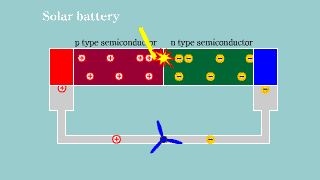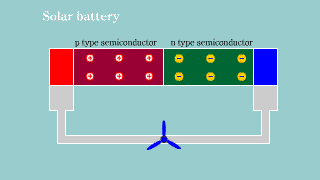
 Fotoogniwo Fotoogniwo |
 |
HTML5 Canvas |
| Jeśli na złącze półprzewodnikowe pn pada światło, to przy odpowiedniej energii fotonów, następuje powstanie dziur i elektronów. Aktywacja nośników ładunku w złączu powoduje powstanie na nim zewnętrznego napięcia elektrycznego. Powstaje bateria. |
|
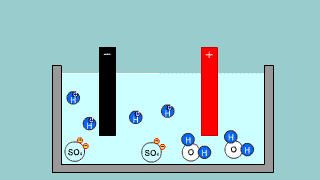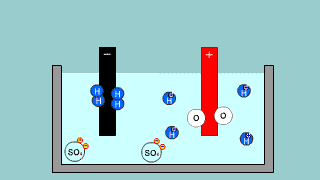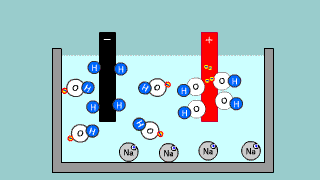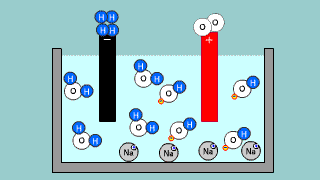
 Elektroliza wody w roztworze H2SO4 Elektroliza wody w roztworze H2SO4 |
 |
HTML5 Canvas |
| Kationy wodoru dążą do elektrody ujemnej (katody). Zachodzi redukcja 2H+ + 2e- → H2 ↑. Na anodzie zachodzi utlenianie wody H2O – 2e- → 2H+ + 1/2O2↑ . Proces redoks zachodzący podczas elektrolizy H2SO4 to elektrolityczny rozkład wody H2O → H2 + 1/2O2↑ . |
|
|